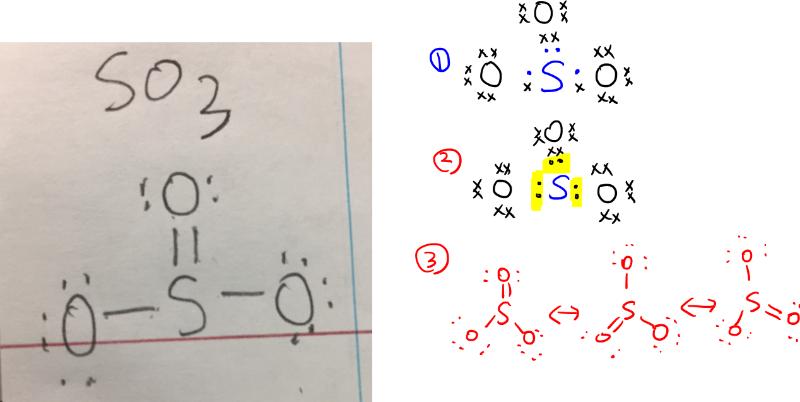안녕하세요 ^^
켈다샘입니다
Lewis structure 는 그렇게 어려운건 아니지만, 처음 배울때는 아무래도 다들 많이 헷갈려하는 파트에요
지금 학생이 그려서 upload 한 이미지대로의 SO3 structure 가 맞습니다
그런데 그렇게 그렸을때 sulfur 의 valence electron 을 4개로 생각한다는 건, 샘이 옆에 그린대로 1번 처럼
학생이 머릿속으로 생각하기 때문이죠, 파란색 점만 sulfur 거겠지 라고 상상하고 있는 거랍니다
그런데 그럴수가 없겠죠? 그러면 양쪽의 oxygen 이 7개씩 electron 을 가져야할테니까요
electron 이 누가 몇개씩 share 했는지 사실 정확하게 모르더라도,
가지고 있는 valence electron 의 dots 를 다 찍어주고
각각이 octet 을 satisfy 하게만 해주면 되는데요
학생분이 잘 알아보실수있게 샘이 2번처럼 다시 그렸습니다
sulfur 의 electron 은 highlight 되어있는 6개인 것이죠
그러면 학생분은 아마, 그럼 양옆에 있는 oxygen 과는 share 하지 않았는데요?
어떻게 그럴수가 있죠? 라고 생각할수 있어요 ^^;;
우선 정답부터 이야기하면 lewis structure 는 그냥 octet 만 satisfy 하면 되기때문에
oxygen 과 sulfur 가 평등하게 equal 하게, 한개씩, 두개씩
꼭 같은 양을 share 할 필요는 없구요
sulfur 가 전적으로 다 sacrificial 하게 share 하여도 상관은 없습니다
그러나 이것의 실제 상태는
샘이 그린 3번과 같은 resonance 입니다
하하^^; 좀 어렵지요
resonance 는 SAT chem 에서는 아주 간단하게 나오거나, 거의 안나오다시피 하는 내용이기 때문에
샘이 여러분에게 혼동을 피하기 위해 개념 강의에선 거의 설명하지 않고 문제풀이에서만 한두문제 배치해두었습니다
resonance의 자세한 개념은 몰라도 되지만,
sulfur 입장에서 어떤 특정 oxygen 에 대한 preference 가 있는 것이 아니기 때문에
하나의 oxygen 과만 double bond, 다른 oxygen 과는 single bond 를 할 필요가 없겠지요
fair 하게? ^^;
골고루 double bond 의 위치를 바꿔가면서
multiple lewis structure를 그려야 SO3가 완벽히 properly expressed 되었다고 말합니다
좀 더 deep 한 이야기는 AP 가서 배운다고 생각하심 되고요
도움되었기를 바랍니다~~
켈다샘이