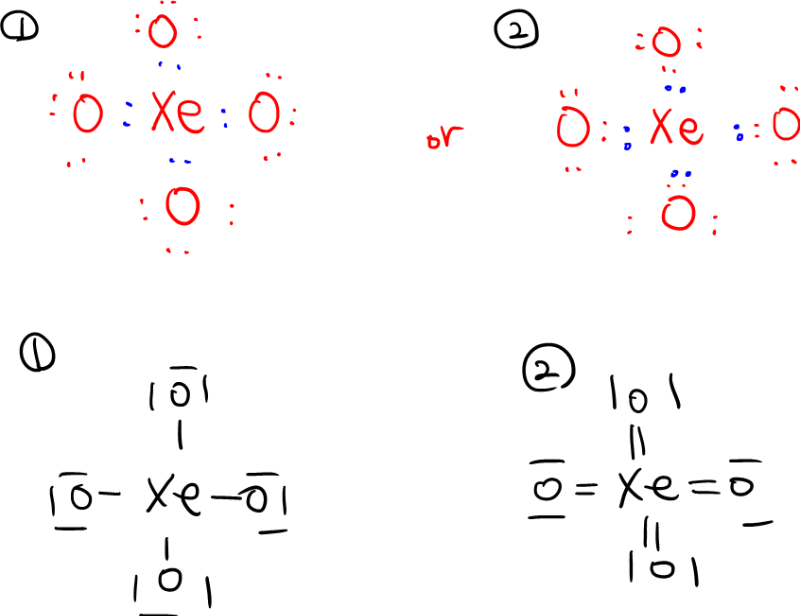안녕하세요 켈다샘입니다 ㅎㅎ
Lewis structure 그리기는 regular chem 레벨에서는 상대적으로 좀 쉽다고 느껴지다가도
AP chem level 에 와서는 많은 친구들이 어렵게 느끼고 힘들어하는 타픽 중에 하나입니다
어려운 것만은 아닌데 아무래도 많이들 헷갈려 하는거 같아요
자 샘이 아래와 같이 XeO4를 두가지로 그려보았습니다
싱글본드 4개를 이용해서 그린 1번과
더블본드 4개를 이용해서 그린 2번이 있습니다
일부러 학생이 알아보기 쉽게 빨간색, 파란색 나누어 표시했는데
oxygen's electron 은 red dots 로
xenon's electron 은 blue dots 로 표시를 했지요
Lewis structure 를 그리는 가장 큰 핵심은 all the number of valence electrons must appear in the structure 라는 겁니다
가지고 있는 valence electron 을 다 use 해야하지요
octet 을 satisfy 해야 하느냐...라고 묻는다면
octet 을 satisfy 하는 경우도 많지만 그만큼 satisfy 하지 않는 경우도 많기 때문에
또 central atom 이 Phosphorus 이후 (atomic number가 15번이거나 그보다 큰 경우)에는
expanded octet 이 가능하기 때문에,
octet 보다 더 중요한 것은 가지고 있는 electron number의 dots 를 모두 다! 찍어준다! 라는 겁니다
어떻게 보면 그것이 제일 중요하고 유일한 rule 입니다 ㅎㅎ
샘처럼 single bond 4개인 1번, 또는 double bond 4개인 2번
어떻게 그리든, 사실 lewis structure 를 그리는 문제에서는 상관이 없습니다
즉 둘다 맞게 해준다는 뜻입니다
1번은 octet 의 입장에서 맞고
2번도 expanded octet 가 가능하니 맞지요
그리고 어떻게 그리시든, 둘다 tetrahedral 에, 둘다 sp3 타입일겁니다
그러면, 그래도,
정말로 누가 맞냐?!
라는 것을 체크할 때
바로 샘이 강의에서 설명한 formal charge 가 필요한 겁니다...
그러나... Lewis structure를 그려라, 또는 geometry 를 찾아라 라는 문제에서는 굳이 formal charge 까지 생각할 필요는 없습니다
그러니 두려워하지 마시고
필요한 electron 의 갯수를 모두다 represent 하는데 초점을 맞추시고
연습하시면 됩니다
화이팅하시고요~
또 다른 example 들 연습해보세요
켈다샘이