안녕하세요 - 질문하신 내용은 ap 시험보다는 훨씬 어려운 파트입니다 (교과서에 나오기 때문에 설명했고, 또 시험엔 안나오지만 이해가 되면, 좋기는 한 파트에요 다만 시험 관련성은 없다고 보심 되세요^^)
G products, G reactants 도
H products, H reactants 와 마찬가지로 개념적으로 나타낼수는 있습니다
그러나 그것에 해당하는 / 대응하는 실질적인 값이 없어요
이해하실지 모르겠지만 enthalpy 는 delta H, 즉 enthalpy change 만 중요하지
enthalpy of a certain chemical 의 값을 숫자로 나타낼수 없습니다
따라서 우리가 indirect 하게 delta H f 즉 enthalpy of formation 을 이용하죠?
그렇게 Gibbs of formation 의 경우에 chemical 마다 값이 주어지지만
G reactants, G products 의 numerical 한 값은 없습니다
다만 Gibbs of reaction 이 + 인지 - 인지에 따라
Gibbs 가 커졌다, 작아졌다
또는 reactant 의 G 가 더 크다
product의 G 가 더 크다. 라는 의미로 쓸 수 있습니다.
그리고 깁스의 그래프의 경우는 ap 보다는 한단계 더 높은 내용이긴 합니다
예를 들어
delta G 가 마이너스라는건 reactant 보다 product의 값이 작다는건데
이게 반드시 linear 하게 내려갈 필요가 없어요
그래서 curve 로 내려간다면
product 의 깁스가 더 작은건 맞는데,
중간 지점에서 (즉 reactant 이 product 으로 100% 바뀌지는 않았을때. )
예를 들어 reactant 80%, product 20% 일때 gibbs 가 최하점 minimum 일수가 있습니다
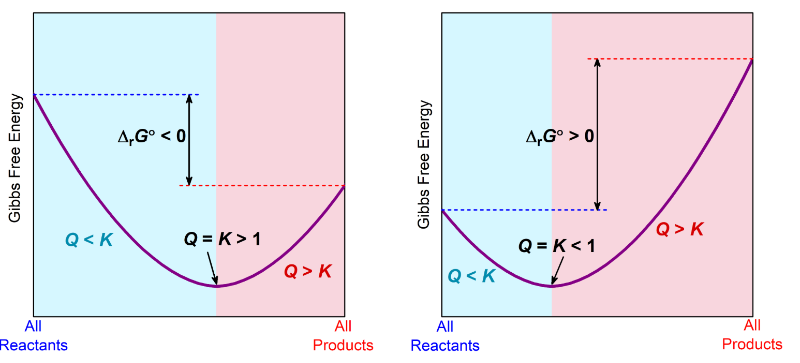
프로덕트가 100프로인 상태의 깁스가
리액턴트가 100프로인 상태의 깁스보다 작더라도
그래프가 curve로 내려가면서 미니멈인 순간이 나타나는거죠
그 미니멈인 순간이 바로 이 리액션이 가지고자 하는 equilibrium composition 의 지점인 것입니다
ㅎㅎ 재밌지요?
그럼 도움되셨기 바랍니다
