안녕하세요 ^^
켈다샘입니다
올해 AP 시험 준비를 위해 열심히 강의를 듣고 있다니 좋네요 마무리까지 잘되어 꼭 좋은 결과 있기 바랍니다 
우선 학생이 말한 그 문제는 비교적 어려운 문제였는데
acid 2가 더 강한 산이라고, 스스로 잘 골랐다는 것만으로도 아주 잘 logically 생각한거 같아요
그런데 학생이 말한 부분중, molarity 가 더 커지면 stronger acid 가 되야 하는데 - 라는 부분은 잘 이해가 안되네요
molarity 가 커진다고 stronger acid 인 것이 아니라
strong acid, weak acid 를 구별하는 기준 자체가 percent dissociation 인 것이죠?!?
자 샘이 밑에다가 문제를 copy and paste 해두었는데요 다시 살펴볼게요
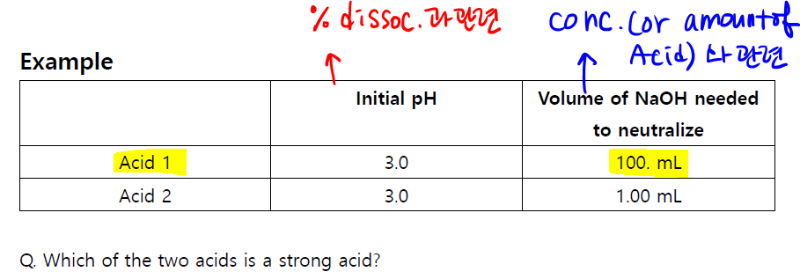
1. Neutralize 하기 위해서 필요한 base 의 양은 strong acid, weak acid 와 관련 없이 항상 nMV = nMV 공식을 썼었죠?
즉, strong 이든 weak 이든 H+ 의 moles 가 많으면 base의 moles 가 많이 필요하게 됩니다
그래서 100.mL 의 base 가 들어가야 하는 acid 1 이 더 진한 것이다 more concentrated 이렇게 이해할수 있습니다.
2. 그러면 strength 를 어떻게 비교하냐..
molarity 가 더 커서가 아니라,
더 큰 molairty 를 가지고있는 acid 1 의 pH 가 3.0
더 작은 molairty 를 가지고 있는 acid 2의 pH 가 3.0
여기에서 percent dissocation에 대해서 생각해보라는 뜻이지요
예를 들면 acid 1은 0.1M 의 HF 인데, pH 가 3.0 이면? 그렇지요 H+ 는 10^-3 M 이니까 dissociate 를 다 못한것이죠? (여기서는 1%네요)
acid 2는 pH 가 3.0 이라면(with lower concentration), 예를 들자면, 0.001M의 HCl 이 fully dissociated 를 해서 pH 3.0 을 만들었을 거란 이야기에요
자 이해가 좀 될까요? 
acid의 strength 는 무조건 percent dissocation 에 대한 문제입니다
그래서 같은 pH 를 갖는다는 것은, 같은 양의 H+ ion 을 가지고 있는 것인데
concentration 이 다른 상태이니까..!!!
더 큰 molarity 를 가지고서도 pH 가 3.0 인 acid 1 이 weak acid 일수밖에 없는 것이지요
>> 잘 이해가 되셨기 바라고요
^^; 여전히 잘 이해가 안되면 다시 질문해주세요~
감사합니다
